1. Calor de Reação
Na
termoquímica são tratados os efeitos térmicos que acompanham as reações
químicas. Quanto à energia calorífica envolvida nas reações químicas, as mesmas
classificam-se em exotérmicas e endotérmicas, conforme se processam com
liberação ou absorção de calor, respectivamente.
A
quantidade de calor liberada ou absorvida em uma reação química em uma reação
química é associada às quantidades molares de reagentes e produtos da reação,
expressas mediante os respectivos coeficientes estequiométricos, denomina-se
calor de reação.
O
calor de reação, determinado experimentalmente por meio de calorímetro, depende
dos seguintes fatores: quantidade de reagentes ou produtos da reação, estado
físico ou variedades alotrópicas dos mesmos numa determinada pressão e
temperatura.
Exemplos:
a) Equação termoquímica de uma reação exotérmica:
REAGENTES à PRODUTOS + CALOR DE REAÇÃO
(p
= 1 atm; T=298 ºK)
b) Equação termoquímica de uma reação endotérmica:
REAGENTES + CALOR DE REAÇÃO à PRODUTOS
(p
= 1 atm; T=298 ºK)
2. Variação de ENTALPIA
A
variação de entalpia ΔH de uma reação química é igual ao calor de reação à
pressão constante Qp da mesma: ΔH = Qp, ou seja, ΔH
representa a diferença (H2 – H1) entre o conteúdo de
energia H2 dos produtos e o conteúdo de energia H1 dos
reagentes, em uma reação química realizada sob pressão constante.
a) REAÇÕES EXOTÉRMICAS:
H2 < H1
e ΔH < 0
b) REAÇÕES ENDOTÉRMICAS:
H2 > H1
e ΔH > 0
Exemplo de reação exotérmica
(p=1 atm, T=298 ºK)
3. Calor de Formação
O calor de formação de um composto químico é igual à
variação de entalpia da reação de formação de 1 mol deste composto a partir de
seus constituintes elementares.
ATENÇÃO: “Constituinte elementar” = formação
alotrópica mais estável (menos energética) de um elemento químico; por
convenção, a entalpia (conteúdo energético) dos constituintes elementares, a 1
atm de pressão e 25º Celsius de temperatura, é igual a ZERO!
Exemplos de constituintes
elementares:
Exemplos de CALOR DE
FORMAÇÃO (p=1 atm, ө=25ºC)
Portanto, o calor de
formação do gás iodídrico é:
CALOR DE FORMAÇÃO VERSUS ESTADO FÍSICO.
Portanto,
O calor de formação da água
no estado líquido = – 68,3 kcal/mol
O calor de formação da água
no estado gasoso = – 57,8 kcal/mol
4. CALOR DE COMBUSTÃO
O calor de combustão de uma
substância é igual à variação de entalpia da reação de combustão completa de 1
mol desta substância.
Exemplos de calores de
combustão (p=1 atm; θ=25 ºC):
Portanto, o calor de
combustão do monóxido de carbono é:
Portanto, o calor de combustão sulfeto de
carbono é:
CALOR DE COMBUSTÃO VERSUS ESTADO FÍSICO.
Portanto,
O elemento químico carbono,
a) forma alotrópica mais estável:
grafite
b) forma alotrópica mais
energética: diamante
5. LEI DE HESS
A quantidade de calor liberada ou absorvida em uma reação
química, sob determinadas condições experimentais, depende exclusivamente dos
estados inicial e final da reação, seja a mesma executada em uma única etapa ou
realizada em várias etapas sucessivas.
Ilustração da LEI de HESS:
APLICAÇÃO PRÁTICA DA LEI DE HESS:
(determinação indireta de
calores de formação)
Portanto, o calor de
formação da água oxigenada (peróxido de hidrogênio) é:
Do princípio dos estados
inicial e final (HESS) decorre:
(1º-) A quantidade de calor
liberada ou absorvida em uma reação química é igual à diferença entre a
somatória dos calores de formação dos produtos da reação (multiplicados pelos
correspondentes números de moles produzidos) e a somatória dos calores de
formação dos reagentes (multiplicados pelos correspondentes números de moles
consumidos).
(2º-) Em uma reação
reversível a quantidade de calor liberada ou absorvida na reação direta é igual
à quantidade de calor absorvida ou liberada na reação inversa.
Exemplo:
6. CALOR DE NEUTRALIZAÇÃO
O
calor de neutralização é igual à variação de entalpia da reação entre 1
equivalente-grama de um ácido em solução aquosa diluída e 1 equivalente-grama
de uma base em solução aquosa diluída.
A
experimentação revela que o calor de neutralização da reação entre um ácido
forte e uma base forte é praticamente constante:
Justificação:
7. ENERGIA DE LIGAÇÃO E ENERGIA DE DISSOCIAÇÃO
Entende-se por energia de ligação à energia liberada no
estabelecimento de 1 mol de enlaces covalentes (simples, ou múltiplas) entre
átomos no estado gasoso.
Entende-se por energia de dissociação à energia absorvida
na ruptura de 1 mol de enlaces covalentes (simples, ou múltiplas) entre átomos
no estado gasoso.
8. ENTROPIA
A
entropia é a grandeza que mede o grau de desordem das moléculas, átomos ou íons
constituintes de uma substância. Quanto
maior é a entropia de uma substância, maior é a desordem das suas partículas
constituintes.
Todas
as substâncias apresentam, no zero absoluto de temperatura, a máxima
organização das suas partículas constituintes. Daí o seguinte PRINCÍPIO DA ENTROPIA: “no zero absoluto
de temperatura a entropia de qualquer substância é nula”.
9. CRITÉRIO DE ESPONTANEIDADE
Sendo ∆H, ∆S e T*∆S respectivamente a
variação de entalpia, a variação de entropia e a variação da energia de
organização referente a um processo realizado sob pressão e temperatura
constantes, então:
10. VARIAÇÃO DA ENERGIA LIVRE (GIBBS)
Em
uma reação química sob pressão e temperatura constantes a variação da energia
livre (∆G) é igual à diferença entre a variação da entalpia (∆H) e a variação
da energia de organização (T∙∆S).
a) ∆S < 0, reação espontânea.
b) ∆S > 0, reação não espontânea (é espontânea a
reação inversa).
c) ∆S = 0, estado de equilíbrio químico



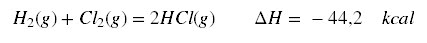






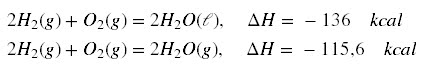

















Nenhum comentário:
Postar um comentário