1) Conceito de EQUILÍBRIO QUÍMICO
Chama-se
reação reversível aquela que se processa simultaneamente nos dois
sentidos. Essas reações são muito
freqüentes na Química; por exemplo:
Nestes exemplos, ocorrem simultaneamente a reação da
esquerda para a direita (chamada Reação
Direta [1]) e da direita para esquerda (chamada Reação Inversa [2].
No exemplo–3, em particular, podemos visualizar as duas reações; todos os gases são
incolores, exceto o NO2 que é vermelho-castanho. Pois bem, misturando-se CO e NO2,
num recipiente de vidro, a 200ºC, visualizamos o andamento da reação direta
pela gradativa diminuição da cor castanha do NO2; vice-versa,
misturando-se CO2 e NO, visualizamos o andamento da reação inversa
pela gradativa formação da cor castanha do NO2.
Dizemos que uma reação reversível atinge um
equilíbrio químico quando as velocidades das reações direta e inversa se
igualam. É importante lembrar que toda reação reversível fatalmente chegará a
um equilíbrio, embora, possa demorar um tempo maior ou menor.
Vamos
considerar a equação genérica:
Sabemos que a velocidade da reação direta é dada por:
A fórmula
mostra que a velocidade diminui com o passar do tempo, pois, a reação direta
consome os reagentes A e B, suas concentrações [A] e [B] vão diminuindo,
diminuindo então v1.
Sabemos que
a velocidade da reação inversa
é dada por:
À medida que a reação direta se processa (=”caminha”),
formam-se quantidades cada vez maiores de C e D, aumentando [C] e [D] e, portanto,
aumentando v2.
Lembrando agora que as reações direta e
inversa ocorrem simultaneamente, é fácil concluir que, diminuindo v1
e aumentando v2, com o passar do tempo, ao fim de um tempo t, as
duas velocidades serão iguais (v1 = v2), e a reação terá
atingido o estado de equilíbrio químico.
Graficamente, temos:
A partir do instante em que o sistema atinge o estado de
equilíbrio químico, tem-se a impressão que a reação cessou, pois não ocorre
mais nenhuma modificação observável. No entanto, as reações direta e inversa
continuam a ocorrer com velocidades iguais. Isto faz com que, ao ser atingido o
equilíbrio, as concentrações molares das substâncias participantes permaneçam
constantes; cada transformação de moléculas reagentes em produtos é compensada
por uma transformação de moléculas produtos em reagentes.
2) CONSTANTES DE EQUILÍBRIO
Sejam Kc e
Kp constantes de equilíbrio, sendo Kc = constante de equilíbrio expressa em
termos das concentrações molares, à temperatura θ; e Kp = constante de equilíbrio expressa em termos das pressões
parciais, à temperatura θ, numa reação
gasosa.
Genericamente:
Reação Reversível Homogênea (temperatura θ)
Kc
= constante de equilíbrio expressa em termos das concentrações molares, à
temperatura θ:
Kp = constante de equilíbrio expressa em termos das pressões
parciais, à temperatura θ, numa reação
gasosa:
Nota:
sendo Kp e Kc as constantes de equilíbrio, à temperatura absoluta T, de uma
reação reversível em fase gasosa, advém da aplicação da equação da equação de
Clapeyron que:
3) DESLOCAMENTO DO EQUILÍBRIO
Princípio
de Le Châtelier: “a variação de um
fator que tem influência no estado de equilíbrio de um sistema reversível,
acarreta um deslocamento do equilíbrio no sentido da reação que tende a se opor
à variação imposta”.
3.1) Variação da concentração: um sistema
reversível em equilíbrio, aumentando (diminuindo) a concentração de um
constituinte do sistema, o equilíbrio é deslocado no sentido da reação de
conversão (formação) deste constituinte.
3.2) Variação da temperatura: em um sistema
reversível em equilíbrio, aumentando (diminuindo) a temperatura do sistema, o
equilíbrio é deslocado no sentido da reação endotérmica (exotérmica).
3.3) Variação da pressão: em um sistema
reversível em equilíbrio, aumentando (diminuindo) a pressão do sistema, o
equilíbrio é deslocado no sentido da reação de contração (expansão) de volume
gasoso.






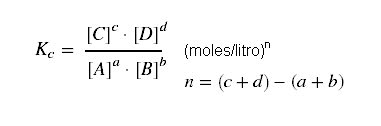


Nenhum comentário:
Postar um comentário