É o estudo da velocidade das reações químicas.
Na vida do dia-a-dia, encontramos reações químicas mais
lentas e mais rápidas.
Exemplo: combustão.
1) VELOCIDADE DAS
REAÇÕES
Dada por exemplo, a reação:
chama-se VELOCIDADE
MÉDIA da reação, ao quociente entre a variação do número de moles de uma
das substâncias pela variação do tempo.
Observações:
1º.) Durante o andamento da reação, os números de moles de CO2 e NO vão aumentando; consequentemente o ∆n correspondente
(nº. final menos nº. inicial de moles) será positivo e a vm também positiva. Pelo contrário, o número e moles de CO e de NO2 diminuem com o tempo; portanto o ∆n
será negativo e a vm
seria também expressa por um número negativo; para evitar que isso aconteça,
costuma-se trocar o sinal algébrico do quociente ∆n/∆t.
Como a velocidade é, em geral, expressa em função dos
reagentes, é mais comum escrevê-la:
Agora, seja a reação seguinte:
2º.) Se, num mesmo intervalo de tempo, forem gastos 10 moles de H2 e 10 moles de I2, iremos
produzir 20 moles de HI. Consequentemente, a velocidade, em função do
HI, seria o dobro da velocidade expressa em função do H2 ou do I2. Para evitar que isso aconteça, costuma-se
dividir a velocidade do HI por dois.
Teremos então:
Genericamente, temos:
VELOCIDADE
INSTANTÂNEA (velocidade da reação, num dado instante) é o limite da
velocidade média quando o intervalo de tempo tende a zero.
Matematicamente, este limite corresponde a uma derivada,
então podemos também definir como:
Observações:
1ª.) Tanto a velocidade média, como a velocidade num dado
instante, costumam ser expressas nas unidades moles/segundo, moles/minuto,
moles/hora, etc..
2ª.) A velocidade de uma dada reação diminui com o
tempo. Traçando-se o gráfico da
velocidade em função do tempo temos:
2) MEDIDA DA
VELOCIDADE DAS REAÇÕES
A
velocidade de uma reação pode ser determinada por processos químicos e físicos.
a) PROCESSOS QUÍMICOS
Medir a velocidade de uma
reação, usando uma segunda reação muito mais rápida (praticamente instantânea)
em relação à primeira. Por exemplo, a saponificação de um éster:
É uma reação lenta que demora
algumas horas. Podemos de tempos em tempos, (por exemplo, de 15 em 15 minutos),
retirar uma amostra do sistema, e titular o NaOH com um ácido, por exemplo:
Deste modo, medimos o consumo de
NaOH na primeira reação, em função do tempo, o qual nos indicará a velocidade
de saponificação do éster.
(Usar o PHmetro)
b) PROCESSOS FÍSICOS
Medir indiretamente a velocidade
da reação, medindo a variação de uma grandeza física (cor, condutividade elétrica,
opacidade, etc.) durante a reação química.
1º. Exemplo: Na reação
todas as substâncias são gases
incolores, exceto o NO2 que é um gás avermelhado. À medida, que a reação caminha a cor vermelha
do NO2 vai desaparecendo. A velocidade
que com que a cor vermelha desaparece, é uma medida da velocidade da própria
reação e será registrada no fotômetro o aparelho.
(Usar fonte de luz e fotômetro)
2º. Exemplo: Na reação
todas as substâncias são
moleculares, exceto o HBr formado, que se dissocia em H+e Br ̶ . A medida que a reação caminha, a formação de H+e Br ̶ vai
aumentando a condutividade elétrica da solução.
A velocidade de aumento da condutividade; e a medida da velocidade da
própria reação será mostrada no amperímetro.
(Usar um amperímetro)
Com avanço da eletrônica, hoje,
podemos realizar as medidas de velocidades de reações de forma contínua, por
exemplo, utilizando a técnica de cromatografia.
3) FATORES QUE INFLUEM
NA VELOCIDADE DAS REAÇÕES
Alguns fatores que aumentam ou
diminuem a velocidade das reações:
a) Estado físico dos reagentes (gasoso,
líquido, sólido).
Como
regra geral, os gases reagem mais facilmente e mais rapidamente que os
líquidos, e estes mais rapidamente que os sólidos. De fato, no estado gasoso, o
contato entre as moléculas reagentes é mais fácil – elas se chocam com muita
frequencia – e a reação é em geral, mais rápida. No estado sólido acontece o oposto.
Uma reação entre íons é, em
geral, mais rápida do que uma reação entre moléculas inteiras.
O
fato de estar ou não em solução:
A
reação
se for efetuada entre AgNO3
e NaCl sólidos, praticamente não ocorrerá. Em solução aquosa, contudo, a reação
será quase instantânea. Isto porque a água irá separar os íons (Ag)+,
(NO3) – e
(Na)+, (Cl) – que
ficarão “prontos” para reagir.
A água é um
solvente muito ionizante; forçando a ionização ou a dissociação do soluto
(reagentes).
b) Superfície de contato
Quanto
maior a superfície de contato, maior o número de moléculas reagindo, maior
número de colisões eficazes, portanto, aumenta a velocidade da reação.
Uma
substância em pó reage mais rápido do que uma substância inteira porque possui
maior superfície de contato. Por
exemplo: gravetos queimam mais rápido do que um pedaço de madeira de mesma
massa
c) Temperatura
A
temperatura está ligada das moléculas.
Quanto mais calor, mais agitadas ficam as moléculas. Se aumenta a
temperatura, aumenta a energia cinética das moléculas; se as moléculas se
movimentam mais, elas se chocam mais e com mais energia; diminuindo a energia
de ativação de ativação e em conseqüência, aumenta o número de colisões
efetivas e portanto a velocidade da reação também aumenta.
Aumenta
a temperatura → aumenta a
velocidade da reação química
Diminuindo
a temperatura → diminui a
velocidade da reação química
Por
este motivo, aumentamos a chama do fogão para cozinhar e utilizamos a geladeira
(ou freezer) para evitar a deterioração mais rápida dos alimentos.
Já foi visto em termoquímica, que a variação de energia, durante o andamento da
reação, é dada pelos gráficos:
Nos gráficos os eixos de energia
representam a entalpia como também a
energia livre. Então em primeira impressão o primeiro
gráfico representa uma reação espontânea
e o segundo uma reação não espontânea. No entanto, mesmo as reações espontâneas, de
um modo geral, não “começam sozinhas”.
A
queima do carvão:
Sendo ∆G < 0, dizemos que a queima do carvão é “espontânea”; porém,
sabemos que um pedaço de carvão não pega fogo “sozinho”; é necessário aquecer
um pouco, até fazê-lo atingir um estado incandescente; daí por diante ele
queimará sozinho.
Este
“empurrão” (aquecimento) inicial, que somos obrigados a dar em quase todas as
reações, é necessário para levar os reagentes a um “estado ativado”, onde se
forma o chamado “complexo ativado”.
Então,
refinando os gráficos anteriores, temos:
d) ELETRICIDADE
Uma faísca elétrica provoca a
explosão da gasolina no motor de um automóvel, ou a reação do hidrogênio com o
oxigênio, etc.. A faísca fornece a energia de ativação, para iniciar o processo
de reação.
e) LUZ
A luz solar e outras radiações eletromagnéticas (especialmente o ultra-violeta) exercem um efeito análogo à eletricidade, fornece a energia de ativação que dá início ao processo de reação.
f) PRESSÃO
Aumentando-se pressão sobre a
mistura reagente, especialmente se for uma mistura gasosa (lembrando que:
sólidos e líquidos são pouco compressíveis), iremos aproximar as moléculas. A
intensidade dos choques entre as moléculas reagentes aumenta e, com isso,
aumenta a velocidade da reação.
g) CONCENTRAÇÃO DOS REAGENTES
Aumentando-se
a concentração dos reagentes (número de moléculas por unidade de volume) iremos
aumentar a freqüência dos choques entre as moléculas reagentes e,
conseqüentemente, aumentar a velocidade da reação.
A
velocidade de uma reação é proporcional às concentrações molares dos reagentes,
elevadas a expoentes iguais aos seus coeficientes na equação química
correspondente.
Seja
uma reação genérica:
Teremos a expressão algébrica
seguinte:
Observações:
a) A concentração de um reagente
pode ser aumentada, aumentando-se o número de moléculas, ou diminuindo o
volume. É por isso que um aumento de pressão, sobre um sistema gasoso, irá
aumentar a velocidade da reação.
b) Num sistema gasoso, as pressões parciais são
proporcionais às concentrações molares (numa mistura gasosa, pressão parcial de
um gás é a pressão desse gás, suposto sozinho, no mesmo volume e temperatura da
mistura):
Demonstração usando a Equação de
Clayperon:
h) CATALISADOR
É a substância que aumenta a
velocidade de uma reação, sem ser consumido
durante o processo.
CATÁLISE
= aumento de velocidade da reação provocado pelo catalisador.
Costuma-se
classificar a catálise em HOMOGÊNEA e HETEROGÊNEA,
conforme o sistema em reação e o catalisador formarem um todo homogêneo ou heterogêneo.
A
catálise homogênea ocorre ou em sistemas gasosos catalisados por um gás ou em sistemas líquidos contendo substâncias e catalisador (sólidos, líquidos
ou gases), todos solúveis entre si.
A
catálise heterogênea surge, em geral, quando uma substância sólida catalisa uma reação entre gases ou líquidos.
A
energia com catalisador:
Principais catalisadores:
1) Metais: especialmente metais de transição, como
Co, Ni, Pd, PT, etc.;
2) Óxidos Metálicos: Al2O3,
Fe2O3, Co2O3, V2O5,
etc.;
3) Ácidos: catalisam muitas reações da Química
Orgânica;
4) Bases: também atuam como catalisadores de muitas
reações;
5) Substâncias que se oxidam e reduzem facilmente.
i) INIBIDOR
É
a substância que diminui (=retarda) a velocidade de uma reação. O inibidor, contudo, distingue-se do
catalisador, porque é consumido pela reação.
j) PROMOTOR (ou ATIVADOR)
É
a substância que acentua o efeito do catalisador, embora a própria sozinha não
tenha nenhum efeito catalítico.
Esta reação é catalisada por
ferro; se ao ferro adicionarmos pequenas quantidades de K2O ou Al2O3,
a ação catalítica do ferro ficará muito mais acentuada; dizemos, então, que o K2O
e o Al2O3 agem como promotores ou ativadores do ferro.
k)
ENZIMAS
São
catalisadores produzidos pelos seres vivos, que aceleram reações de interesse
ao metabolismo do próprio ser vivo.
Podemos afirmar que, sem a colaboração das enzimas, seria impossível a
vida dos vegetais e animais, como a conhecemos aqui no planeta Terra.
As
enzimas são substâncias complexas, de natureza protéica e coloidal, e que agem
de maneira muito específica –isto é, só catalisam um tipo muito bem definido
de reação.
Cinemática Química - INFORMAÇÕES ADICIONAIS
REAÇÃO ELEMENTAR:
Ocorre em uma única etapa; os produtos se formam diretamente
da colisão dos reagentes. Isto é: Não há formação de intermediários; os
produtos se formam diretamente da colisão dos reagentes;
Reação elementar
genérica:
A velocidade de uma reação química elementar, a uma dada
temperatura, é diretamente proporcional ao produto das concentrações dos
reagentes, em mol/L, elevadas aos seus respectivos coeficientes
estequiométricos.
A lei de
velocidade apresenta os expoentes iguais aos coeficientes da reação.
REAÇÃO NÃO ELEMENTAR:
Ocorrem em um
conjunto de etapas, chamado mecanismo
de reação. Então, como faremos para determinar a expressão da velocidade de uma
reação não elementar? Isso é feito com os dados experimentais.
Mecanismo de reação: Cada etapa e uma reação elementar;
na soma algébrica das
etapas, os compostos intermediários desaparecem na reação
global.
A velocidade da reação não elementar
depende apenas da etapa lenta.
EXEMPLO
Qual
a lei de velocidade da reação que ocorre segundo o mecanismo a seguir?
Já
sabemos que a velocidade da reação não elementar depende apenas da etapa
lenta. Portanto,
Seja uma
equação genérica: 2A + 3B + C g Produtos e
os seguintes experimentos e respectivos resultados:
Observando
a tabela dos experimentos, podemos escrever a lei de velocidade da reação.
A
concentração do reagente C não foi considerada nesta expressão da velocidade
porque a velocidade inicial manteve-se constante, mesmo variando a
concentração.
Ordem de uma reação
Ordem
de reação (ordem global) é a soma dos valores das potências a que as concentrações
de reagentes se encontram elevadas na equação cinética da reação (lei de
velocidade).
Consideremos
a reação geral:
A equação da
velocidade assume a forma:
α, β, k – determinados experimentalmente
α e β – ordem de uma reação;
A
reação tem ordem global (α+ β)
Uma reação é de:
Ordem
zero em relação a um reagente: se a alteração da concentração desse
reagente não causa alteração na velocidade;
Primeira
ordem em relação a um reagente: se duplicar a concentração, duplica a
velocidade da reação também;
Ordem n
em relação a um reagente: se duplicar a concentração aumenta de 2n a velocidade
da reação.
Se acontecer de
mudarmos a concentração de uma substância reagente e a velocidade da reação não
se alterar, a ordem de reação dessa substância será igual a zero e esta
substância não participa da equação da velocidade.
A relação entre a concentração versus
tempo e tempo de meia vida.



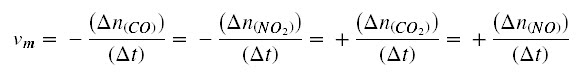





















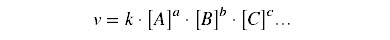
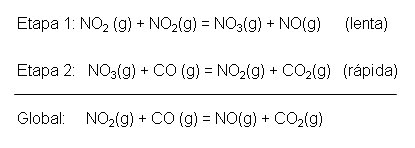
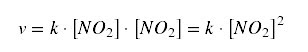





Nenhum comentário:
Postar um comentário